ACIDOS Y BASES
ÁCIDOS Y BASES EN LA
VIDA COTIDIANA
ÁCIDO CITRICO:
El ácido cítrico es un ácido orgánico tricarboxílico,2 presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja. Su fórmula molecular es C6H8O7.
Es un buen conservante y antioxidante natural que se añade industrialmente como aditivo en el envasado de muchos alimentos como las conservas de vegetales enlatadas.
ÁCIDO ASCÓRBICO: Es originario de la naranja.
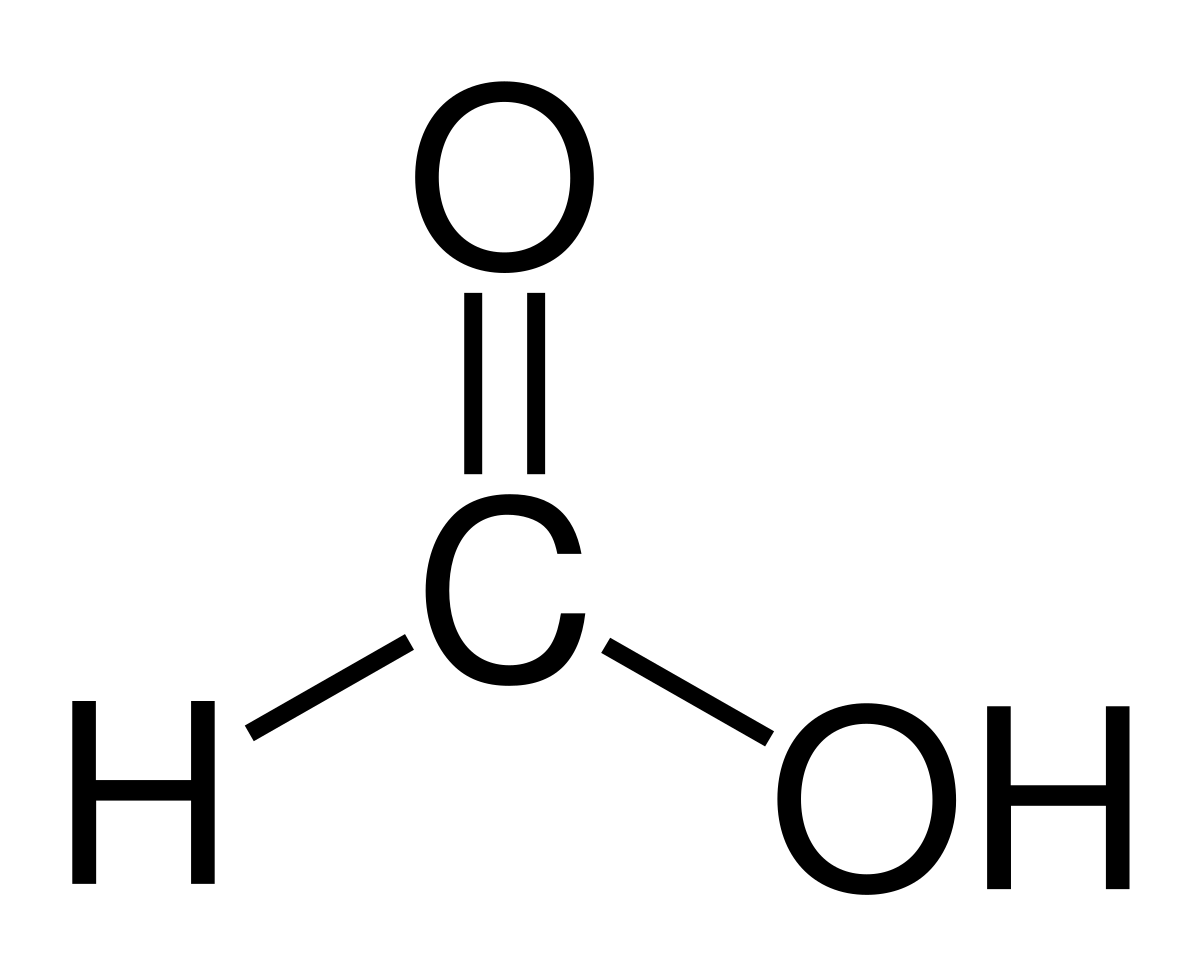
ÁCIDO FÓRMICO:
PROPIEDADES:
- Es un líquido incoloro humeante, con un olor irritante similar al vinagre, con un peso molecular de 46 g/mol.
- Completamente soluble en agua, éter o alcohol, debido a su corta cadena carbonada.
- Pese a ser un ácido natural relativamente fuerte, se corroe fácilmente ante la acción de oxidantes suaves.
- Se descompone al calentarse intensamente, y en contacto con ácidos fuertes produce monóxido de carbono.
- Reacciona violentamente con bases y ácidos fuertes, originando riesgo de incendio o explosión.
- Destruye algunos plásticos y metales.
- Puede ser obtenido por una gran cantidad de métodos de síntesis orgánica y como subproducto de otras.
- La sustancia es muy corrosiva para los ojos, la piel y el tracto respiratorio, dando lugar a acidosis y edema pulmonar. DONDE ENCONTRAMOS EL ÁCIDO FÓRMICO:
Hormigas.
 El ácido fórmico, es usado por las hormigas como un mecanismo defensivo, produciendo picor y dolor cuando nos muerden.Aunque una mordida de hormiga no representa un peligro para los humanos, sufrir muchas de ellas, puede provocar una reacción alérgica.Igualmente, el mordisco de una hormiga roja origina hinchazón, enrojecimiento en la piel, además de picazón.
El ácido fórmico, es usado por las hormigas como un mecanismo defensivo, produciendo picor y dolor cuando nos muerden.Aunque una mordida de hormiga no representa un peligro para los humanos, sufrir muchas de ellas, puede provocar una reacción alérgica.Igualmente, el mordisco de una hormiga roja origina hinchazón, enrojecimiento en la piel, además de picazón.Abejas.
 Estos insectos tienen una picadura ácida, debido a que el veneno llamado apitoxina, entre otros componentes, posee ácido fórmico.Por ello, el aguijoneo de una abeja produce una reacción más extensa que la de una hormiga, y que se puede neutralizar aplicándose amoníaco.
Estos insectos tienen una picadura ácida, debido a que el veneno llamado apitoxina, entre otros componentes, posee ácido fórmico.Por ello, el aguijoneo de una abeja produce una reacción más extensa que la de una hormiga, y que se puede neutralizar aplicándose amoníaco.Ortiga.
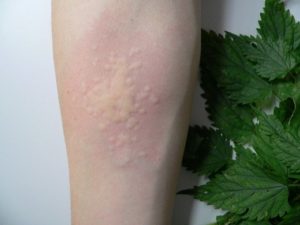 Entre las distintas especies vegetales con ácido fórmico, se encuentra la ortiga, que produce urticaria con solo tocarla.Se caracteriza porque sus tallos y hojas están cubiertos de pelos formados por este compuesto, y al contacto con la piel se inyectan en ella.
Entre las distintas especies vegetales con ácido fórmico, se encuentra la ortiga, que produce urticaria con solo tocarla.Se caracteriza porque sus tallos y hojas están cubiertos de pelos formados por este compuesto, y al contacto con la piel se inyectan en ella.Bacterias del grupo entérico.
 Siendo microorganismos que habitan en los intestinos de los animales y personas, tienen propiedades para producir ácido fórmico.Generalmente suelen provocar enfermedades, siendo la más frecuente la samonella o intoxicación alimentaria.En todos estos casos, las personas alérgicas a este compuesto orgánico desarrollan consecuencias más graves e incluso la muerte por shock anafiláctico.De acuerdo a ello, el estado alérgico de la persona llega a un estado que provoca un paro cardiorrespiratorio.
Siendo microorganismos que habitan en los intestinos de los animales y personas, tienen propiedades para producir ácido fórmico.Generalmente suelen provocar enfermedades, siendo la más frecuente la samonella o intoxicación alimentaria.En todos estos casos, las personas alérgicas a este compuesto orgánico desarrollan consecuencias más graves e incluso la muerte por shock anafiláctico.De acuerdo a ello, el estado alérgico de la persona llega a un estado que provoca un paro cardiorrespiratorio.
PARA QUE SE UTILIZA EL ÁCIDO FÓRMICO:
Actualmente la obtención del ácido metanoico se realiza mediante la síntesis del monóxido de carbono, de esta manera se emplea en las siguientes industrias:
Farmacéutica.

Empleado en la fabricación de medicinas para eliminar verrugas, callosidades y las irregularidades de la piel causadas por el VPH.
En este caso, el ácido penetra en el tejido, secando la irregularidad, que al paso de los días termina cayéndose.
Cuero.

Es usado para desgrasar y eliminar el pelo de los cueros, igualmente a manera de aditivo químico para el curtido.
Ganadería.

Aplicado en la alimentación del ganado debido a que su marcado efecto antimicrobiano es capaz deimpedir el crecimiento de bacterias patógenas.
Petrolera y gasífera.

Utilizado en los fluidos para estimular la perforación de los pozos de petróleo o gas a altas temperaturas, optimizando y reduciendo la corrosión.
Apicultura.

En el tratamiento de un tipo de ácaro llamado varroa, evitando que la producción de miel se contamine y se pierda.
Acuicultura.

Como suplemento en la dieta de los camarones, permitiendo reducir los brotes de vibriosis luminosa, una enfermedad que afecta a esta especie marina.
Química.

En la síntesis de productos orgánicos y como catalizador en la producción de formiatos.
Otros usos.

Como acidificante del látex en la fabricación de cauchos, y en la industria de pesticidas se emplea en la producción de fumigantes e insecticidas.
También es usado como desinfectante en la limpieza ácida, para la elaboración del acero y la pulpa durante la fabricación del papel.
Destinado como persevante en la industria alimenticia, y conservante en la elaboración del vino y la cerveza.
Los últimos adelantos de la tecnología han logrado sustituir las corrientes baterías de celulares u ordenadores portátiles, por pilas de combustibles realizadas con ácido fórmico.
ÁCIDO ACETILSALICÍLICO

Como de buen seguro sabrás, nos encontramos ante un fármaco conocido popularmente con el nombre de aspirina, aunque abreviado también es conocido médicamente con el nombre de AAS, cuya estructura química es C9H8O4.
Consiste en un antiinflamatorio no esteroideo (AINE), funcionando de manera bastante similar a otros antiinflamatorios AINE, con la diferencia de ser capaz de bloquear el normal funcionamiento de las plaquetas, actuando como veremos como antiagregante plaquetario.
Se obtiene a partir del sauce blanco, cuyo nombre científico es Salix alba, y sobre el que al parecer existen ya cierta constancia acerca de su uso médico a lo largo de la historia. De hecho, muchos historiadores coinciden en señalar que ya los antiguos egipcios podrían haber utilizado la corteza de este árbol con fines medicinales, al igual que tanto los chinos como los sumerios utilizaban sus hojas por sus cualidades analgésicas.
PROPIEDADES Y USOS
El ácido acetilsalicílico es reconocido por sus propiedades analgésicas, antiinflamatorias, antiagregantes y antipiréticas, es un fármaco muy usado desde el punto de vista médico.
Como analgésico el ácido acetilsalicílico es capaz de aliviar los dolores musculares, de cabeza, de muela y articulares.
Posee la propiedad de reducir la inflamación de tejidos blandos causados por un traumatismo, golpe o enfermedad.
Es muy eficaz y efectivo como antipirético o como medicamento para bajar la fiebre, no produce hipotermia, y su efecto tiene una duración de 2 o 3 horas.
Es un anticoagulante por excelencia, evitando que la sangre se estanque e impidiendo la formación trombos sanguíneos, siendo esta propiedad la única diferencia con otros antiinflamatorios no esteroideos o aines.
Normalmente el ácido acetilsalicílico es recetado para pacientes de infarto agudo de miocardio y personas con problemas de circulación.
Sirve para tratar o prevenir la angina de pecho.
Son útiles en el tratamiento de la gota debido a su efecto antiinflamatorio y uricosuricos como coadyuvante.
Recomendado para los ataques isquémicos transitorios y los accidentes cerebrovasculares.
Alivia los síntomas de artritis, tal como hinchazón, rigidez, y dolor de las articulaciones, sin embargo no la cura.
También se usa para disminuir la posibilidad de una embolia, ataque al corazón u otros problemas causados por coágulos de sangre, impidiendo la formación de trombos sanguíneos.
Algunos estudios científicos constatan que 1 a 5 aspirinas al día pueden evitar tanto infartos como trombos.
Las ventajas de este fármaco son las siguientes:
- Las mujeres que toman ácido acetilsalicílico varias veces a la semana tienen menos probabilidad de padecer cáncer de mama.
- Protege al cuerpo contra la enfermedad de Parkinson.
- Previene los ataques de asma en mujeres de mediana edad.
- Reduce el riesgo de la preeclampsia durante el embarazo, en dosis muy bajas.
Entre las desventajas se encuentran:
- Su uso regular en incrementa el riesgo de pérdida auditiva en hombres.
- No ofrece protección contra ataques del corazón en personas diabéticas.
- Puede causar alteraciones en los estudios de próstata.
- Las dosis altas estimulan el sistema nervioso central causando efectos tóxicos.
- Su consumo en personas de la tercera edad provoca alteraciones en el sueño.
ACIDO HIALURONICO

El ácido hialurónico es una sustancia que se encuentra en numerosos tejidos y órganos de nuestro cuerpo como, por ejemplo, en el tejido conectivo que sostiene la columna vertebral, en los cartílagos, en el líquido sinovial de las articulaciones o en nuestra epidermis. Con el paso del tiempo, la presencia de esta sustancia disminuye notablemente, lo que produce, entre otras razones, el envejecimiento de la piel y, con ello, la aparición de arrugas, flaccidez o pérdida de firmeza.
Una de las principales propiedades del ácido hialurónico es su gran capacidad para atraer y retener el agua. Por este motivo, su empleo en tratamientos cosméticos de aplicación tópica permite rehidratar en profundidad la epidermis de la zona tratada para que su aspecto sea más terso y, al aumentar su grosor y volumen, disminuyan también los surcos de la piel.
Usos estéticos del ácido hialurónico
El ácido hialurónico fue descubierto en el año 1934, aunque su uso en la cosmética, por el que se hizo popular, no comenzó hasta mitad de los años 90. La aplicación de ácido hialurónico en los tratamientos de belleza y estéticos se debe a que su principal propiedad es la de aumentar el volumen e hidratación de la piel, haciendo que ésta luzca mucho más tersa y radiante.
Las arrugas y la flaccidez de la piel asociadas al paso de los años vienen determinadas en gran medida por la pérdida de hidratación, por la reducción del ácido hialurónico presente en nuestra piel y por la disminución de la capacidad de nuestro organismo para reponerlo.
En medicina estética, esta sustancia se inyecta en función de las necesidades de cada paciente para corregir los signos del envejecimiento. Las zonas más comunes en las que se aplica son:
- Contorno y comisura de los labios.
- Volumen labial y facial (pómulos).
- Arrugas labiales o peribucales (alrededor de la boca).
- Surcos nasogenianos (líneas de expresión que van desde a ambos lados de la nariz hacia la boca).
- Arrugas perioculares externas (patas de gallo).
ÁCIDO ACÉTICO

¿Qué es el ácido acético y para qué sirve?
El ácido acético es un compuesto orgánico líquido incoloro cuya fórmula química es CH3COOH (también escrito como CH3CO2H o C2H4O2). Cuando no se diluye, a veces se le llama ácido acético glacial. El vinagre es aproximadamente 3-9% de ácido acético en volumen, lo que hace del ácido acético el principal componente del vinagre aparte del agua.
El ácido acético tiene un sabor ácido distintivo y un olor picante. Además del vinagre doméstico, se produce principalmente como precursor del acetato de polivinilo y del acetato de celulosa. Se clasifica como un ácido débil ya que sólo se disocia parcialmente en solución, pero el ácido acético concentrado es corrosivo y puede atacar la piel.
El ácido acético es el segundo ácido carboxílico más simple (después del ácido fórmico). Consiste en un grupo metílico unido a un grupo carboxilo.Es un importante reactivo químico y químico industrial, utilizado principalmente en la producción de acetato de celulosa para películas fotográficas, acetato de polivinilo para cola de madera, fibras sintéticas y tejidos.
En los hogares, el ácido acético diluido se utiliza a menudo en los agentes desincrustantes. En la industria alimentaria, el ácido acético está controlado por el aditivo alimentario E260 como regulador de la acidez y como condimento. Como aditivo alimentario está aprobado para su uso en muchos países, entre ellos el Canadá, la Unión Europea, los Estados Unidos, Australia y Nueva Zelanda.

En la bioquímica, el grupo acetilo, derivado del ácido acético, es fundamental para todas las formas de vida. Cuando se une a la coenzima A, es fundamental para el metabolismo de carbohidratos y grasas.
La demanda mundial de ácido acético se sitúa en torno a los 6,5 millones de toneladas métricas anuales (Mt/a), de las cuales aproximadamente 1,5 Mt/a son recicladas; el resto se fabrica a partir de metanol.El vinagre es principalmente ácido acético diluido, a menudo producido por fermentación y posterior oxidación del etanol.
Nomenclatura del acido acetico
El nombre trivial ácido acético es el más utilizado y preferido por IUPAC.El nombre sistemático ácido etanoico, un nombre válido de la IUPAC, se construye de acuerdo con la nomenclatura sustitutiva. El nombre ácido acético deriva del acetum, la palabra latina para vinagre, y se relaciona con la palabra ácido mismo.
El ácido acético glacial es un nombre para el ácido acético anhídrido libre de agua. Al igual que el nombre alemán Eisessig (hielo-vinagre), el nombre proviene de los cristales helados que se forman ligeramente por debajo de la temperatura ambiente a 16,6 °C (61,9 °F) (la presencia de 0,1% de agua reduce su punto de fusión en 0,2 °C).
En el contexto de las reacciones ácido-base, a veces se utiliza la abreviatura HAc, donde Ac en este caso es un símbolo para acetato (en lugar de acetilo). El acetato es el ión resultante de la pérdida de H+ del ácido acético. El nombre acetato también puede referirse a una sal que contiene este anión o a un éster de ácido acético.
Propiedades del acido acetico
El centro de hidrógeno en el grupo carboxilo (-COOH) en ácidos carboxílicos como el ácido acético puede separarse de la molécula por ionización. Debido a esta liberación del protón (H+), el ácido acético tiene carácter ácido.

El ácido acético es un ácido monoprótico débil. En solución acuosa, tiene un valor pKa de 4,76. Su base conjugada es acetato (CH3COO-). Una solución de 1,0 M (aproximadamente la concentración de vinagre doméstico) tiene un pH de 2,4, lo que indica que sólo el 0,4% de las moléculas de ácido acético están disociadas.
Estructura
En el ácido acético sólido, las moléculas forman cadenas y las moléculas individuales están interconectadas por enlaces de hidrógeno. En el vapor a 120 °C (248 °F) se pueden detectar dimers. También se producen en la fase líquida en soluciones diluidas en disolventes no aglutinantes de hidrógeno, y en cierta medida en ácido acético puro, pero se ven alterados por disolventes aglomerantes de hidrógeno.
La entalpía de disociación del dimer se estima en 65.0-66.0 kJ/mol, y la entropía de disociación en 154-157 J mol-1 K-1.20] Otros ácidos carboxílicos participan en interacciones similares de enlace intermolecular de hidrógeno.
Propiedades del disolvente
El ácido acético líquido es un solvente protico hidrofílico (polar), similar al etanol y al agua. Con una permitividad estática relativa moderada (constante dieléctrica) de 6.2, disuelve no sólo compuestos polares como sales inorgánicas y azúcares, sino también compuestos no polares como aceites y solutos polares.
Es miscible con solventes polares y no polares como agua, cloroformo y hexano. Con alcanos más altos (comenzando con octano), el ácido acético no es completamente miscible, y su miscibilidad disminuye con alcanos n más largos. Las propiedades de disolvente y miscibilidad del ácido acético lo convierten en un producto químico industrial útil, por ejemplo, como disolvente en la producción de tereftalato de dimetilo.
Bioquímica
A pH fisiológicos, el ácido acético suele ionizarse completamente en acetato.
El grupo acetilo, formalmente derivado del ácido acético, es fundamental para todas las formas de vida. Cuando se une a la coenzima A, es fundamental para el metabolismo de carbohidratos y grasas. A diferencia de los ácidos carboxílicos de cadena más larga (ácidos grasos), el ácido acético no se encuentra en los triglicéridos naturales. Sin embargo, la triacetina triglicérida artificial (triacetato de glicerina) es un aditivo alimenticio común y se encuentra en cosméticos y medicamentos tópicos.
El ácido acético es producido y excretado por bacterias de ácido acético, notablemente el género Acetobacter y Clostridium acetobutylicum. Estas bacterias se encuentran universalmente en los alimentos, el agua y el suelo, y el ácido acético se produce de forma natural a medida que las frutas y otros alimentos se estropean. El ácido acético es también un componente de la lubricación vaginal de humanos y otros primates, donde parece servir como agente antibacteriano leve.
Producción del ácido acetico
El ácido acético se produce industrialmente tanto sintéticamente como por fermentación bacteriana. Aproximadamente el 75% del ácido acético que se utiliza en la industria química se fabrica mediante la carbonilación del metanol, que se explica a continuación. La ruta biológica sólo representa alrededor del 10% de la producción mundial, pero sigue siendo importante para la producción de vinagre porque muchas leyes de pureza alimentaria exigen que el vinagre utilizado en los alimentos sea de origen biológico.

Otros procesos son la isomerización de formateado de metilo, la conversión de gas sintético en ácido acético y la oxidación en fase gaseosa de etileno y etanol. El ácido acético es a menudo un producto secundario de reacciones diferentes, es decir, durante la síntesis heterogénea de ácido acrílico catalítico o la producción de ácido láctico fermentativo.
A partir de 2003-2005, la producción mundial total de ácido acético virgen se estimaba en 5 Mt/a (millones de toneladas anuales), de las cuales aproximadamente la mitad se producía en los Estados Unidos. La producción europea fue de aproximadamente 1 Mt/a y disminuyó, mientras que la producción japonesa fue de 0,7 Mt/a.
Cada año se reciclaron 1,5 Mt más, con lo que el total del mercado mundial se eleva a 6,5 Mt/a. Desde entonces, la producción mundial ha aumentado a 10,7 Mt/a (en 2010), y aún más; sin embargo, se prevé una ralentización en este aumento de la producción.Los dos mayores productores de ácido acético virgen son Celanese y BP Chemicals. Otros productores importantes incluyen Millennium Chemicals, Sterling Chemicals, Samsung, Eastman y Svensk Etanolkemi.
Carbonilación de metanol
La mayoría del ácido acético se produce por carbonilación de metanol. En este proceso, el metanol y el monóxido de carbono reaccionan para producir ácido acético.
Dos procesos relacionados para la carbonilación del metanol: el proceso Monsanto catalizado por rodio, y el proceso Cativa catalizado por iridio.Este último proceso es más ecológico y eficiente y ha sustituido en gran medida al primero, a menudo en las mismas plantas de producción. En ambos procesos se utilizan cantidades catalíticas de agua, pero el proceso de Cativa requiere menos, por lo que se suprime la reacción de cambio de agua-gas y se forman menos subproductos.

Al alterar las condiciones del proceso, también puede producirse anhídrido acético en la misma planta utilizando los catalizadores de rodio.
Oxidación de acetaldehído
Antes de la comercialización del proceso Monsanto, la mayor parte del ácido acético se producía por oxidación del acetaldehído. Este sigue siendo el segundo método de fabricación más importante, aunque generalmente no es competitivo con la carbonilación del metanol. El acetaldehído puede ser producido por hidratación de acetileno. Esta era la tecnología dominante a principios de 1900.
Los componentes ligeros de la nafta se oxidan fácilmente con oxígeno o incluso aire para dar peróxidos, que se descomponen para producir ácido acético.
Tales oxidaciones requieren catalizador metálico, como las sales de naftenato de manganeso, cobalto y cromo.
La reacción típica se lleva a cabo a temperaturas y presiones diseñadas para ser lo más caliente posible mientras se mantiene el butano líquido.También pueden formarse productos secundarios, incluyendo butanona, acetato de etilo, ácido fórmico y ácido propiónico.
Estos productos secundarios también son comercialmente valiosos, y las condiciones de reacción pueden ser alteradas para producir más de ellos donde sea necesario. Sin embargo, la separación del ácido acético de estos subproductos aumenta el coste del proceso.
En condiciones similares y utilizando catalizadores similares a los utilizados para la oxidación del butano, el oxígeno en el aire para producir ácido acético puede oxidar el acetaldehído.
Usando catalizadores modernos, esta reacción puede tener un rendimiento de ácido acético superior al 95%. Los principales productos secundarios son el acetato de etilo, el ácido fórmico y el formaldehído, todos los cuales tienen puntos de ebullición más bajos que el ácido acético y se separan fácilmente por destilación.
Oxidación de etileno
El acetaldehído puede prepararse a partir del etileno mediante el proceso de Wacker, y luego oxidarse como se ha indicado anteriormente.
En tiempos más recientes, la empresa química Showa Denko, que abrió una planta de oxidación de etileno en, Japón, en 1997, comercializó una conversión de etileno a ácido acético en una sola etapa más barata. El proceso es catalizado por un catalizador metálico de paladio soportado en un ácido heteropólico como el ácido silicio-pulmonar. Un proceso similar utiliza el mismo catalizador metálico en ácido siliconolítico y silicio.
El enfoque se basará en la utilización de una novedosa tecnología de oxidación fotocatalítica selectiva para la oxidación selectiva de etileno y etanol en ácido acético. A diferencia de los catalizadores de oxidación tradicionales, el proceso de oxidación selectiva utiliza la luz UV para producir ácido acético a temperatura y presión ambiente.
Fermentación oxidativa
Durante la mayor parte de la historia humana, las bacterias de ácido acético del género Acetobacter han producido ácido acético, en forma de vinagre. Con suficiente oxígeno, estas bacterias pueden producir vinagre a partir de una variedad de alimentos alcohólicos. Los alimentos comúnmente usados incluyen sidra de manzana, vino y granos fermentados, malta, arroz o puré de papas.

Una solución de alcohol diluida inoculada con Acetobacter y mantenida en un lugar cálido y ventilado se convertirá en vinagre durante unos meses. Los métodos de vinagres industriales aceleran este proceso al mejorar el suministro de oxígeno a las bacterias.
Los primeros lotes de vinagre producidos por fermentación probablemente siguieron errores en el proceso de vinificación. Si el mosto se fermenta a una temperatura demasiado alta, el acetobacteriano abruma la levadura que se encuentra naturalmente en las uvas.
A medida que aumentaba la demanda de vinagre para fines culinarios, médicos e higiénicos, los vinicultores aprendieron rápidamente a utilizar otros materiales orgánicos para producir vinagre en los meses calurosos del verano, antes de que las uvas estuvieran maduras y listas para su transformación en vino. Este método era lento, sin embargo, y no siempre exitoso, ya que los vinicultores no entendían el proceso.
Uno de los primeros procesos comerciales modernos fue el “método rápido” o “método alemán”, practicado por primera vez en Alemania en 1823. En este proceso, la fermentación se realiza en una torre con virutas de madera o carbón vegetal.
La alimentación que contiene alcohol se introduce en la parte superior de la torre y el aire fresco suministrado desde la parte inferior por convección natural o forzada. El mejor suministro de aire en este proceso reduce el tiempo de preparación del vinagre de meses a semanas.
Hoy en día, la mayor parte del vinagre se elabora en el cultivo de cubas sumergidas, descrito por primera vez en 1949 por Otto Hromatka y Heinrich Ebner. En este método, el alcohol se fermenta en vinagre en un tanque de agitación continua, y el oxígeno es suministrado por medio de burbujas de aire a través de la solución. Utilizando las aplicaciones modernas de este método, el vinagre de ácido acético al 15% puede ser preparado en sólo 24 horas en proceso por lotes, incluso el 20% en proceso fed-batch de 60 horas.
Fermentación anaerobia
Las especies de bacterias anaeróbicas, incluidos los miembros del género Clostridium o Acetobacterium, pueden convertir los azúcares en ácido acético directamente sin crear etanol como intermediario.
Estas bacterias acetogénicas producen ácido acético a partir de compuestos de un solo carbono, incluyendo metanol, monóxido de carbono o una mezcla de dióxido de carbono e hidrógeno.
Esta habilidad de Clostridium para metabolizar azúcares directamente, o para producir ácido acético a partir de insumos menos costosos, sugiere que estas bacterias podrían producir ácido acético más eficientemente que los oxidantes de etanol como Acetobacter. Sin embargo, las bacterias de Clostridium son menos resistentes a los ácidos que las de Acetobacter.

Incluso las cepas de Clostridium más resistentes a los ácidos pueden producir vinagre en concentraciones de sólo un pequeño porcentaje, en comparación con las cepas de Acetobacter que pueden producir vinagre en concentraciones de hasta el 20%. En la actualidad, sigue siendo más rentable producir vinagre con Acetobacter que con Clostridium y concentrarlo. Como resultado, aunque las bacterias acetogénicas han sido conocidas desde 1940, su uso industrial se limita a unas pocas aplicaciones específicas.
¿Qué función tiene el ácido acético?
El ácido acético es un reactivo químico para la producción de compuestos químicos. El mayor uso individual del ácido acético se da en la producción de monómero de acetato de vinilo, seguido de cerca por la producción de anhídrido acético y éster. El volumen de ácido acético utilizado en el vinagre es relativamente pequeño.
Monómero de acetato de vinilo
El uso principal del ácido acético es la producción de monómero de acetato de vinilo (VAM). En 2008, se estimó que esta aplicación consumía un tercio de la producción mundial de ácido acético. La reacción consiste en etileno y ácido acético con oxígeno sobre un catalizador de paladio, conducido en la fase gaseosa.
El acetato de vinilo puede ser polimerizado a acetato de polivinilo u otros polímeros, que son componentes en pinturas y adhesivos.

Producción Ester
Los ésteres principales del ácido acético se utilizan comúnmente como disolventes para tintas, pinturas y revestimientos. Los ésteres incluyen el acetato de etilo, el acetato de n-butilo, el acetato de isobutilo y el acetato de propilo. Se producen típicamente por reacción catalizada del ácido acético y el alcohol correspondiente.
Sin embargo, la mayoría de los ésteres de acetato se producen a partir del acetaldehído mediante la reacción de Tishchenko. Además, los acetatos de éter se utilizan como solventes para nitrocelulosa, lacas acrílicas, removedores de barnices y tintes de madera. En primer lugar, los monoéteres de glicol se producen a partir de óxido de etileno u óxido de propileno con alcohol, que luego se esterifican con ácido acético.
Los tres productos principales son el acetato de etilenglicol y monoetil éter de etilenglicol y acetato de etileno y monobutilo y monometil éter de etileno y acetato de propilenglicol y monometilo y éter (PMA, más comúnmente conocido como PGMEA en los procesos de fabricación de semiconductores, donde se utiliza como disolvente resistente. Esta aplicación consume entre el 15% y el 20% del ácido acético mundial. Se ha demostrado que los acetatos de éter, por ejemplo el EEE, son nocivos para la reproducción humana.
Anhídrido acético
El producto de la condensación de dos moléculas de ácido acético es el anhídrido acético. La producción mundial de anhídrido acético es una aplicación importante, y utiliza aproximadamente del 25% al 30% de la producción mundial de ácido acético. El proceso principal consiste en la deshidratación del ácido acético para obtener ceteno a 700-750 °C. A continuación, el ceteno se reacciona con ácido acético para obtener el anhídrido.
El anhídrido acético es un agente de acetilación. Como tal, su principal aplicación es el acetato de celulosa, un textil sintético que también se utiliza para la película fotográfica. El anhídrido acético es también un reactivo para la producción de heroína y otros compuestos.
Uso médico del ácido acético
La inyección de ácido acético en el tumor se ha utilizado para tratar el cáncer desde el siglo XIX.
Es un componente esencial en el vinagre, que tiene infinidad de usos en nutrición, uno de ellos es su función para destapar los oídos.
El ácido acético se utiliza como parte del cribado del cáncer cervical en muchas áreas del mundo en desarrollo. Se aplica ácido acético en el cuello uterino y si aparece un área blanca después de aproximadamente un minuto, la prueba es positiva.
Es un antiséptico efectivo cuando se usa como solución al 1%, con amplio espectro de acción contra estreptococos, estafilococos, pseudomonas, enterococos y otros. Puede ser una opción para las infecciones cutáneas causadas por pseudomonas resistentes a los antibióticos típicos.
Aunque el ácido acético diluido se utiliza en la iontoforesis, no existen pruebas de alta calidad que apoyen este tratamiento en la enfermedad del manguito rotador.
Como tratamiento para la otitis externa, está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud, los medicamentos más importantes que se necesitan en un sistema de salud básico.
Alimentos
El vinagre es típicamente 4-18% de ácido acético en masa. El vinagre se utiliza directamente como condimento y en el encurtido de verduras y otros alimentos. El vinagre de mesa tiende a ser más diluido (4% a 8% de ácido acético), mientras que el decapado de alimentos comerciales emplea soluciones más concentradas.

La proporción de ácido acético utilizada en todo el mundo como vinagre no es tan grande como los usos comerciales, pero es con mucho la aplicación más antigua y conocida.
Reacciones del ácido acético.
Dos reacciones orgánicas típicas del ácido acético:
Reacciones con compuestos orgánicos
El ácido acético sufre las reacciones químicas típicas de un ácido carboxílico. Tras el tratamiento con una base estándar, se convierte en acetato metálico y agua. Con bases fuertes (p. ej. reactivos organolíticos) se puede desgotonar doblemente para dar LiCH2CO2Li. La reducción del ácido acético da etanol.
El grupo OH es el principal lugar de reacción, como lo ilustra la conversión del ácido acético en cloruro de acetilo. Otros derivados de sustitución incluyen el anhídrido acético; este anhídrido se produce por la pérdida de agua de dos moléculas de ácido acético. Los ésteres del ácido acético también pueden formarse mediante la esterificación de Fischer, y las amidas pueden formarse.
Cuando se calienta a más de 440 °C (824 °F), el ácido acético se descompone para producir dióxido de carbono y metano, o para producir ceteno y agua.
Reacciones con compuestos inorgánicos
El ácido acético es ligeramente corrosivo para los metales, incluyendo hierro, magnesio y zinc, formando gas hidrógeno y sales llamadas acetatos.
Debido a que el aluminio forma una película pasivante resistente al ácido de óxido de aluminio, los tanques de aluminio se utilizan para transportar ácido acético. Los acetatos metálicos también se pueden preparar con ácido acético y una base apropiada, como en la reacción popular de “bicarbonato de sodio + vinagre”.
Una reacción de color para las sales del ácido acético es la solución de cloruro de hierro (III), que resulta en un color rojo profundo que desaparece después de la acidificación. Una prueba más sensible usa nitrato de lantano con yodo y amoniaco para dar una solución azul. Acetatos al calentarse con trióxido de arsénico forman óxido de cacodilo, que puede ser detectado por sus vapores malolientes.
Otros derivados
Las sales orgánicas o inorgánicas se producen a partir de ácido acético, incluyendo:
- Acetato de sodio, utilizado en la industria textil y como conservante alimentario (E262).
- Acetato de cobre (II), utilizado como pigmento y fungicida.
- Acetato de aluminio y acetato de hierro (II)-utilizados como mordientes para colorantes.
- Acetato de paladio (II), utilizado como catalizador para reacciones orgánicas de acoplamiento como la reacción Heck.
- Acetato de plata, utilizado como pesticida.
Los ácidos acéticos sustituidos producidos incluyen:
- Ácido cloroacético (ácido monocloroacético, MCA), ácido dicloroacético (considerado un subproducto) y ácido tricloroacético. El MCA se utiliza en la fabricación del tinte añil.
- El ácido bromacético, que se esterifica para producir el reactivo bromoacetato de etilo.
- Ácido trifluoroacético, que es un reactivo común en la síntesis orgánica.
Las cantidades de ácido acético utilizadas en estas otras aplicaciones juntas (aparte de TPA) representan otro 5-10% del uso de ácido acético en todo el mundo. Sin embargo, no se espera que estas aplicaciones aumenten tanto como la producción de TPA.
Historia del acido acetico
El vinagre fue conocido en la civilización temprana como el resultado natural de la exposición de la cerveza y el vino al aire, porque las bacterias productoras de ácido acético están presentes en todo el mundo.
El uso del ácido acético en la alquimia se extiende hasta el siglo III a. C., cuando el filósofo griego Theophrastus describió cómo el vinagre actuaba sobre los metales para producir pigmentos útiles en el arte, incluyendo el plomo blanco (carbonato de plomo) y el verdigris, una mezcla verde de sales de cobre incluyendo el acetato de cobre (II).

Los antiguos romanos hervían vino agrio para producir un jarabe muy dulce llamado sapa. El sapa que se producía en macetas de plomo era rico en acetato de plomo, una sustancia dulce también llamada azúcar de plomo o azúcar de Saturno, que contribuyó al envenenamiento por plomo entre la aristocracia romana.
En el siglo XVI, el alquimista alemán Andreas Libavius describió la producción de acetona a partir de la destilación en seco del acetato de plomo, decarboxilación cetónica. La presencia de agua en el vinagre tiene un efecto tan profundo sobre las propiedades del ácido acético que durante siglos los químicos creyeron que el ácido acético glacial y el ácido encontrado en el vinagre eran dos sustancias diferentes. El químico francés Pierre Adet demostró que eran idénticos.
Ácido acético cristalizado.
En 1845, el químico alemán Hermann Kolbe sintetizó por primera vez el ácido acético de compuestos inorgánicos. Esta secuencia de reacción consistió en la cloración del disulfuro de carbono al tetracloruro de carbono, seguida de la pirólisis al tetracloroetileno y de la cloración acuosa al ácido tricloroacético, y concluyó con la reducción electrolítica al ácido acético.
Hacia 1910, la mayor parte del ácido acético glacial se obtuvo del licor pirolíneo, producto de la destilación de la madera. El ácido acético fue aislado por tratamiento con leche de cal, y el acetato de calcio resultante se acidificó con ácido sulfúrico para recuperar el ácido acético. En aquella época, Alemania producía 10.000 toneladas de ácido acético glacial, de las cuales alrededor del 30% se utilizaba para la fabricación de colorantes añil.
Debido a que tanto el metanol como el monóxido de carbono son materias primas básicas, la carbonilación del metanol durante mucho tiempo pareció ser un precursor atractivo del ácido acético. Henri Dreyfus, de British Celanese, ya en 1925 desarrolló una planta piloto de carbonilación de metanol.
El primer proceso comercial de carbonilación de metanol, que utilizó un catalizador de cobalto, fue desarrollado por la empresa química alemana BASF en 1963. En 1968, se descubrió un catalizador a base de rodio (cis-[Rh (CO)2I2I2]-) que podía funcionar eficientemente a menor presión y casi sin subproductos.
La empresa química estadounidense Monsanto Company construyó la primera planta utilizando este catalizador en 1970, y la carbonilación de metanol catalizado por rodio se convirtió en el método dominante de producción de ácido acético. A finales de los años noventa, la empresa química BP Chemicals comercializó el catalizador Cativa ([Ir (CO)2I2I2-], promovido por iridium para una mayor eficiencia.
Este proceso de Cativa catalizado por iridio es más ecológico y eficiente, por ello ha suplantado en gran medida al proceso de Monsanto, a menudo en las mismas plantas de producción.
Medio interestelar
Se detectó por primera vez en la nube molecular de Sagitario B2 Norte (conocida también como la fuente de Heimat de molécula grande de Sgr B2). El ácido acético tiene la distinción de ser la primera molécula descubierta en el medio interestelar utilizando únicamente interferómetros radioeléctricos; en todos los descubrimientos moleculares anteriores del ISM realizados en los regímenes de longitud de onda milimétrica y centímetros, los radiotelescopios de plato único fueron, al menos en parte, responsables de las detecciones.
¿Qué propiedades tiene el acido acetico en el ser humano?
El ácido acético concentrado es corrosivo para la piel y, por lo tanto, debe manipularse con el cuidado adecuado para evitar quemaduras en la piel, daños oculares permanentes e irritación de las membranas mucosas. Estas quemaduras o ampollas pueden no aparecer hasta horas después de la exposición.
El contacto prolongado de la piel con el ácido acético glacial puede provocar la destrucción de los tejidos. La exposición por inhalación (ocho horas) a vapores de ácido acético a 10 ppm puede producir cierta irritación de los ojos, la nariz y la garganta; a 100 ppm se puede producir una irritación pulmonar marcada y un posible daño a los pulmones, los ojos y la piel.
Las concentraciones de vapor de 1.000 ppm causan una irritación marcada de los ojos, la nariz y el tracto respiratorio superior y no pueden ser toleradas. Estas predicciones se basaron en experimentos con animales y exposición industrial. La sensibilización de la piel al ácido acético es rara, pero ha ocurrido.
Se ha informado que, en 12 trabajadores expuestos durante dos o más años a una concentración media de ácido acético en el aire de 51 ppm (estimada), se produjeron síntomas de irritación conjuntiva, irritación de las vías respiratorias superiores y dermatitis hiperqueratótica.
La exposición a 50 ppm o más es intolerable para la mayoría de las personas y resulta en lagrimeo intensivo e irritación de los ojos, nariz y garganta, con edema faríngeo y bronquitis crónica. Los humanos no aclimatados experimentan irritación ocular y nasal extrema en concentraciones superiores a 25 ppm, y se ha reportado conjuntivitis por concentraciones inferiores a 10 ppm.
En un estudio de cinco trabajadores expuestos durante siete a 12 años a concentraciones de 80 a 200 ppm en los picos, los principales hallazgos fueron ennegrecimiento e hiperqueratosis de la piel de las manos, conjuntivitis (pero sin daño corneal), bronquitis y faringitis, y erosión de los dientes expuestos (incisores y caninos).
Las soluciones con más del 25% de ácido acético se manejan en una campana de humos debido al vapor corrosivo y penetrante. El ácido acético diluido, en forma de vinagre, es prácticamente inofensivo. Sin embargo, la ingestión de soluciones más fuertes es peligrosa para la vida humana y animal. Puede causar daño severo al sistema digestivo y un cambio potencialmente letal en la acidez de la sangre.
Debido a las incompatibilidades, se recomienda mantener el ácido acético alejado del ácido crómico, etilenglicol, ácido nítrico, ácido perclórico, permanganatos, peróxidos e hidroxilos.
El ácido acético concentrado sólo se puede encender con dificultad a temperatura y presión estándar, pero se convierte en un riesgo inflamable en temperaturas superiores a 39 °C (102 °F), y puede formar mezclas explosivas con el aire a temperaturas más altas (límites explosivos: 5,4-16%).
ACIDO SULFURICO

El ácido sulfúrico (H2SO4) es un compuesto químico líquido, aceitoso e incoloro, soluble en agua con liberación de calor y corrosivo para los metales y tejidos. Carboniza la madera y la mayor parte de la materia orgánica al entrar en contacto con ella, pero es poco probable que cause un incendio.
El ácido sulfúrico es quizás el más importante de todos los productos químicos industriales pesados. El consumo de ácido sulfúrico ha sido citado muchas veces como un indicador del estado general de la economía de una nación.

La exposición prolongada a bajas concentraciones o la exposición a corto plazo a altas concentraciones puede resultar en efectos adversos para la salud.
Con mucho, el uso más importante del ácido sulfúrico es en la industria de fertilizantes fosfatados.
Otras aplicaciones importantes del ácido sulfúrico se encuentran en el refinado de petróleo, la producción de pigmentos, el decapado de acero, la extracción de metales no ferrosos y la fabricación de explosivos, detergentes, plásticos, fibras artificiales y productos farmacéuticos.
Características
Propiedades físicas y químicas

El ácido sulfúrico pertenece al grupo reactivo de los ácidos oxidantes fuertes.
Reacciones con el aire y el agua
– La reacción con el agua es despreciable a menos que la acidez esté por encima del 80-90%, entonces el calor de la hidrólisis es extremo, puede causar quemaduras graves.
Inflamabilidad
– Los ácidos oxidantes fuertes son generalmente no inflamables. Pueden acelerar la combustión de otros materiales al proporcionar oxígeno al sitio de combustión.
– Sin embargo, el ácido sulfúrico es altamente reactivo y capaz de encender materiales combustibles finamente divididos al entrar en contacto con ellos.
– Cuando se calienta, emite humos altamente tóxicos.
– El ácido sulfúrico es explosivo o incompatible con una enorme variedad de sustancias.
– Puede sufrir cambios químicos violentos a altas temperaturas y presión.
– Puede reaccionar violentamente con el agua.
Reactividad
– El ácido sulfúrico es fuertemente ácido.
– Reacciona violentamente con pentafluoruro de bromo.
– Explota con para-nitrotolueno a 80 °C.
– Se produce una explosión cuando el ácido sulfúrico concentrado se mezcla con permanganato de potasio cristalino en un recipiente que contiene humedad. Se forma heptóxido de manganeso, que explota a 70 °C.
– La mezcla de acrilonitrilo con ácido sulfúrico concentrado debe mantenerse bien refrigerado, de lo contrario ocurre una reacción exotérmica vigorosa.
– La temperatura y la presión aumentan al mezclar, en un recipiente cerrado, ácido sulfúrico (96%) en porciones iguales con cualquiera de las sustancias siguientes: acetonitrilo, acroleína, 2-aminoetanol, hidróxido de amonio (28%), anilina, n-butiraldehído, clorosulfónico ácido, diamina de etileno, etilenimina, epiclorhidrina, cianohidrina de etileno, ácido clorhídrico (36%), ácido fluorhídrico (48,7%), propiolactona, óxido de propileno, hidróxido de sodio, monómero de estireno.
– El ácido sulfúrico (concentrado) es extremadamente peligroso en contacto con carburos, bromatos, cloratos, materiales fulminantes, picratos, y metales en polvo.
– El ácido sulfúrico puede inducir la polimerización violenta del cloruro de alilo.El ácido sulfúrico reacciona exotérmicamente con hipoclorito de sodio para producir gas cloro.
– Mezclando ácido clorosulfurico y ácido sulfúrico al 98% se obtiene HCl.
Toxicidad
-El ácido sulfúrico es corrosivo para todos los tejidos del cuerpo. La inhalación de vapor puede causar daño pulmonar grave. El contacto con los ojos puede resultar en pérdida total de la visión. El contacto con la piel puede producir necrosis severa.
-La ingestión de ácido sulfúrico, en una cantidad entre 1 cucharadita y media onza del producto químico concentrado, puede resultar fatal para un adulto. Incluso unas gotas pueden ser fatales si el ácido consigue acceso a la tráquea.
-La exposición crónica puede causar traqueobronquitis, estomatitis, conjuntivitis y gastritis. La perforación gástrica y la peritonitis pueden ocurrir y pueden ser seguidas de colapso circulatorio. El choque circulatorio es a menudo la causa inmediata de la muerte.
-Aquellos con enfermedades respiratorias, gastrointestinales o nerviosas crónicas y cualquier enfermedad ocular y cutánea corren mayor riesgo.
Usos
-El ácido sulfúrico es uno de los productos químicos industriales más utilizados en el mundo. Pero, la mayoría de sus usos pueden ser considerados como indirectos, participando como reactivo en lugar de como ingrediente
-La mayor parte del ácido sulfúrico termina como el ácido gastado en la producción de otros compuestos, o como algún tipo de residuo de sulfato.
-Cierto número de productos incorporan el azufre o el ácido sulfúrico, pero casi todos ellos son productos especiales de bajo volumen.
-Alrededor del 19% del ácido sulfúrico producido en el 2014 se consumió en una veintena de procesos químicos, y el resto se consumió en una amplia variedad de aplicaciones industriales y técnicas.
-El crecimiento en la demanda de ácido sulfúrico a nivel mundial se debe, en orden decreciente, a la producción de: ácido fosfórico, dióxido de titanio, ácido fluorhídrico, sulfato de amonio y en el procesamiento de uranio y aplicaciones metalúrgicas.
Indirectos
-El mayor consumidor de ácido sulfúrico es, con mucha diferencia, la industria de fertilizantes. Representó poco más del 58% del consumo mundial total en 2014. Sin embargo, se espera que esta proporción disminuya hasta aproximadamente el 56% para el 2019, principalmente como resultado del mayor crecimiento de otras aplicaciones químicas e industriales.
-La producción de materiales fertilizantes fosfatados, en especial el ácido fosfórico, es el principal mercado del ácido sulfúrico. El ácido fosfórico, a su vez se utiliza para la fabricación de materiales fertilizantes tales como superfosfato triple y fosfatos mono y diamónico. Cantidades menores se utilizan para la producción de superfosfato y sulfato de amonio.
-En otras aplicaciones de la industria, cantidades sustanciales de ácido sulfúrico se utilizan como un medio de reacción de deshidratación ácida, en procesos de química orgánica y petroquímicos que implican reacciones tales como la nitración, la condensación y deshidratación, así como en la refinación del petróleo, donde se utiliza en la refinación, alquilación, y purificación de destilados de crudo.
-En la industria química inorgánica es notable el uso del ácido sulfúrico en la producción de pigmentos de TiO2, ácido clorhídrico y ácido fluorhídrico.
-En la industria de procesamiento de metales, se usa ácido sulfúrico para el decapado de acero, la lixiviación de minerales de cobre, uranio, y vanadio en el procesamiento hidrometalúrgico de minerales, y en la preparación de baños electrolíticos para la purificación y chapado de metales no ferrosos.
-Ciertos procesos de la fabricación de pasta de madera en la industria del papel, en la producción de algunos textiles, en la fabricación de fibras químicas y en el curtido de pieles, también requieren de ácido sulfúrico.
Directos
-Probablemente el uso más grande del ácido sulfúrico en el cual el azufre es incorporado en el producto final, es en el proceso de sulfonación orgánica, en particular para la producción de detergentes.
-La sulfonación también juega un papel importante en la obtención de otros productos químicos orgánicos y productos farmacéuticos menores.
-Las baterías de plomo-ácido constituyen uno de los productos de consumo que contienen ácido sulfúrico más conocidos, y representan sólo una pequeña fracción del consumo total de ácido sulfúrico.
-Bajo ciertas condiciones, el ácido sulfúrico se utiliza directamente en la agricultura, para la rehabilitación de suelos muy alcalinos, tales como los que se encuentran en las regiones desérticas del oeste de Estados Unidos. Sin embargo este uso no es muy importante en términos del volumen total de ácido sulfúrico empleado.
El desarrollo de la industria del ácido sulfúrico
Proceso del vitriolo

El método más antiguo para obtener ácido sulfúrico es el llamado “proceso del vitriolo”, que se basa en la descomposición térmica de los vitriolos, que son sulfatos de diversos tipos, de origen natural.
Los alquimistas persas, Jābir ibn Hayyān (también conocido como Geber, 721 – 815 DC), Razi (865 – 925 DC) y Jamal Din al-Watwat (1318 DC) incluyeron al vitriolo en sus listas de clasificación de minerales.
La primera mención al “proceso del vitriolo” aparece en los escritos de Jabir ibn Hayyan. Luego, los alquimistas San Alberto Magno y Basilius Valentinus describieron el proceso con más detalle. Se usaban alumbre y calcantita (vitriolo azul) como materias primas.
A finales de la Edad Media, el ácido sulfúrico se obtenía en pequeñas cantidades en recipientes de vidrio, en los cuales se quemaba azufre con salitre en un ambiente húmedo.
El proceso del vitriolo se empleó a escala industrial a partir del siglo XVI debido una mayor demanda del ácido sulfúrico.
El foco de la producción se centro en la ciudad alemana de Nordhausen (por lo que empezó a denominarse al vitriolo como “vitriolo de Nordhausen”), donde se utilizaba sulfato de hierro (II) (vitriolo verde, FeSO4 – 7H2O) como materia prima, el cual se calentaba, y el trióxido de azufre resultante se mezclaba con agua para obtener el ácido sulfúrico (aceite de vitriolo). El proceso se llevaba a cabo en galeras, algunas de las cuales tenían varios niveles, en paralelo, a fin de obtener mayores cantidades de aceite de vitriolo.

En el siglo XVIII se desarrolló un proceso más económico para la producción del ácido sulfúrico conocido como el “proceso de cámaras de plomo”.
Hasta entonces la concentración máxima de ácido obtenido era del 78%, mientras que con el “proceso del vitriolo” se obtenía ácido concentrado y óleum, por lo que éste método se siguió empleando en determinados sectores de la industria hasta la aparición del “proceso de contacto” en 1870, con el que se podía obtener ácido concentrado de forma más barata.
El óleum o ácido sulfúrico fumante (CAS: 8014-95-7), es una solución de consistencia aceitosa y color café oscuro, de composición variable de trióxido de azufre y ácido sulfúrico, que puede ser descrito por la fórmula H2SO4.xSO3 (donde x representa el contenido molar libre de óxido de azufre (VI)). Un valor para x de 1 da la fórmula empírica H2S2O7, que corresponde al ácido disulfúrico (o ácido pirosulfúrico).
Proceso de la cámara de plomo
El proceso de la cámara de plomo fue el método industrial usado para producir ácido sulfúrico en grandes cantidades, antes de ser suplantado por el “proceso de contacto”.
En 1746 en Birmingham, Inglaterra, John Roebuck empezó a producir ácido sulfúrico en cámaras con revestimiento de plomo, que eran más fuertes y menos costosas que los recipientes de vidrio que se habían utilizado anteriormente, y podían hacerse mucho más grandes.
El dióxido de azufre (proveniente la combustión de azufre elemental o de minerales metálicos que contienen azufre, como la pirita) se introducía con vapor y óxido de nitrógeno en grandes cámaras revestidas con hojas de plomo.
El dióxido de azufre y dióxido de nitrógeno se disolvían y, durante un período de aproximadamente 30 minutos, el dióxido de azufre se oxidaba a ácido sulfúrico.
Esto permitió la industrialización efectiva de la producción de ácido sulfúrico y, con varios refinamientos, este proceso siguió siendo el método estándar de producción durante casi dos siglos.
En 1793, Clemente y Desormes lograron mejores resultados mediante la introducción de aire suplementario en el proceso de cámaras de plomo.
En 1827, Gay-Lussac introdujo un método para absorber los óxidos de nitrógeno de los gases residuales de la cámara de plomo.
En 1859, Glover desarrolló un método para la recuperación de óxidos de nitrógeno a partir del ácido recién formado, mediante arrastre con gases calientes, que hizo posible hacer el proceso de catalizado con óxido de nitrógeno de manera continua.
En 1923, Petersen introdujo un proceso de torre mejorado que permitió su competitividad con respecto al procedimiento de contacto hasta la década de 1950.
El proceso de cámara llego a ser tan robusto que en 1946 todavía representaba el 25% de la producción mundial de ácido sulfúrico.
Proceso de contacto
El proceso de contacto es el método actual de producción de ácido sulfúrico en altas concentraciones, necesarias en los procesos industriales modernos. El platino solía ser el catalizador de esta reacción. Sin embargo, ahora se prefiere pentóxido de vanadio (V2O5).
En 1831, en Bristol, Inglaterra, Peregrine Phillips patentó la oxidación de dióxido de azufre a trióxido de azufre utilizando un catalizador de platino a temperaturas elevadas.
Sin embargo, la adopción de su invención, y el desarrollo intensivo del proceso de contacto, comenzó sólo después de que la demanda de óleum para la fabricación de tinte aumentara a partir de 1872 aproximadamente.
A continuación, se buscaron mejores catalizadores sólidos, y se investigaron la química y la termodinámica del equilibrio de SO2 / SO3.
El proceso de contacto puede dividirse en cinco etapas:
- Combinación de azufre y dioxígeno (O2) para formar dióxido de azufre.
- Purificación del dióxido de azufre en una unidad de purificación.
- Adición de un exceso de dioxígeno al dióxido de azufre en presencia del catalizador pentóxido de vanadio, a temperaturas de 450 °C y presión de 1-2 atm.
- El trióxido de azufre formado se añade al ácido sulfúrico que da lugar a óleum (ácido disulfúrico).
- El óleum se añade entonces al agua para formar ácido sulfúrico que está muy concentrado.

La desventaja fundamental de los procesos de óxido de nitrógeno (durante el proceso de la cámara de plomo) es que la concentración del ácido sulfúrico obtenido está limitada a un máximo de 70 a 75%, mientras que el proceso de contacto produce ácido concentrado (98%).
Con el desarrollo de catalizadores de vanadio relativamente baratos para el proceso de contacto, junto con la creciente demanda de ácido sulfúrico concentrado, la producción mundial de ácido sulfúrico en plantas de procesamiento de óxido de nitrógeno disminuyó de manera constante.
Para 1980 ya no se producía prácticamente ningún ácido en las plantas de proceso de óxido de nitrógeno en Europa occidental y América del Norte.
Proceso de doble contacto
El proceso de doble contacto doble absorción (DCDA o Double Contact Double Absorption) introdujo mejoras al proceso de contacto para la producción de ácido sulfúrico.
En 1960, Bayer solicito una patente para el llamado proceso de catálisis doble. La primera planta que utilizó este proceso, se puso en marcha en 1964.
Mediante la incorporación de una etapa de absorción de SO3 preliminar antes de las etapas catalíticas finales, el proceso de contacto mejorado permitió un aumento importante en la conversión de SO2 , reduciendo sustancialmente sus emisiones a la atmosfera.
Los gases se pasan de nuevo a través de la columna de absorción final, obteniendo no sólo un alto rendimiento de conversión de SO2 a SO3 (de aprox. 99,8%), sino también permitiendo la producción de una concentración más alta de ácido sulfúrico.
La diferencia esencial entre este proceso y el proceso ordinario de contacto está en el número de etapas de absorción.
A partir de la década de 1970, los principales países industriales introdujeron regulaciones más estrictas para la protección del medio ambiente, y el proceso de doble absorción se fue generalizando en las nuevas plantas. Sin embargo, el proceso de contacto convencional sigue siendo utilizando en muchos países en desarrollo con normas ambientales menos exigentes.
El mayor impulso para el desarrollo actual del proceso de contacto se centra en el aumento de la recuperación y utilización de la gran cantidad de energía producida en el proceso.
De hecho, una planta grande y moderna de ácido sulfúrico puede ser vista no sólo como una planta química, sino también como una planta de energía térmica.
Materias primas usadas en la producción de ácido sulfúrico
La pirita fue la materia prima dominante en la producción de ácido sulfúrico hasta mediados del siglo XX, cuando grandes cantidades de azufre elemental empezaron a ser recuperadas a partir del proceso de refinación del petróleo y de la purificación del gas natural, convirtiéndose en la principal materia prima de la industria.
Actualmente, el dióxido de azufre es obtenido por diferentes métodos, a partir de varias materias primas.
En los Estados Unidos, la industria se ha basado desde los primeros años del siglo XX en la obtención de azufre elemental a partir de depósitos subterráneos por el “Proceso Frasch”.
El ácido sulfúrico moderadamente concentrado también es producido por la reconcentración y la purificación de grandes cantidades de ácido sulfúrico obtenido como subproducto de otros procesos industriales.
El reciclado de este ácido, es cada vez más importante desde el punto de vista del medio ambiente, especialmente en los principales países desarrollados.
La fabricación de ácido sulfúrico a base de azufre elemental y pirita es, por supuesto, relativamente sensible a las condiciones del mercado, puesto que el ácido producido a partir de estos materiales representa un producto primario.
Por el contrario, cuando el ácido sulfúrico es un producto secundario, fabricado como un medio de eliminar los residuos de otro proceso, el nivel de su producción no está dictado por las condiciones en el mercado del ácido sulfúrico, sino por las condiciones del mercado para el producto primario.
Efectos Clínicos
-El ácido sulfúrico se utiliza en la industria y en algunos productos de limpieza del hogar, como limpiadores de baño. También se utiliza en las baterías.
-La ingestión deliberada, en particular de productos de alta concentración, puede provocar lesiones graves y la muerte. Estas exposiciones por ingestión son poco comunes en los Estados Unidos, pero son frecuentes en otras partes del mundo.
-El ácido sulfúrico es un ácido fuerte que causa lesión de los tejidos y coagulación de las proteínas. Es corrosivo para la piel, ojos, nariz, membranas mucosas, tracto respiratorio y el tracto gastrointestinal, o cualquier tejido con el que entre en contacto.
-La gravedad de la lesión está determinada por la concentración y la duración del contacto.
-Las exposiciones más leves (concentraciones de menos del 10%), sólo causan irritación de la piel, las vías respiratorias superiores y la mucosa gastrointestinal.
-Los efectos respiratorios de la exposición aguda por inhalación incluyen: irritación de la nariz y la garganta, tos, estornudos, broncoespasmo reflejo, disnea y edema pulmonar. La muerte puede ocurrir por un colapso circulatorio repentino, edema de glotis y compromiso de las vías respiratorias, o lesión pulmonar aguda.
-La ingestión de ácido sulfúrico puede causar dolor epigástrico inmediato, náuseas, salivación y vómitos de material mucoide o hemorrágico con aspecto de “café molido”. Ocasionalmente se observa vómito de sangre fresca.
-La ingestión de ácido sulfúrico concentrado puede producir la corrosión de esófago, necrosis y perforación del esófago o el estómago, especialmente en el píloro. De vez en cuando se observa lesión en el intestino delgado. Las complicaciones posteriores pueden incluir la estenosis y la formación de fístulas. Luego de la ingestión se puede desarrollar acidosis metabólica.
-Las quemaduras graves de la piel pueden ocurrir con necrosis y cicatrización. Estas pueden ser fatales si se ve afectada un área lo suficientemente amplia de la superficie corporal.
-El ojo es especialmente sensible a la lesión por corrosión. Irritación, lagrimeo y conjuntivitis puede desarrollarse incluso con bajas concentraciones de ácido sulfúrico. Las salpicaduras con ácido sulfúrico en altas concentraciones causan: quemaduras en la córnea, la pérdida de la visión y ocasionalmente perforación del globo.
-La exposición crónica puede estar asociada con cambios en la función pulmonar, bronquitis crónica, conjuntivitis, enfisema, infecciones respiratorias frecuentes, gastritis, erosión del esmalte dental, y posiblemente cáncer del aparato respiratorio.
Seguridad y Riesgos
Declaraciones de peligro del Sistema Globalmente Armonizado de clasificación y etiquetado de productos químicos (SGA).
El Sistema Globalmente Armonizado de clasificación y etiquetado de productos químicos (SGA) es un sistema acordado internacionalmente, creado por las Naciones Unidas diseñado para reemplazar las diversas normas de clasificación y etiquetado utilizadas en diferentes países mediante el uso de criterios coherentes a nivel mundial (Naciones Unidas, 2015).
Las clases de peligro (y su correspondiente capítulo del SGA), las normas de clasificación y etiquetado, y las recomendaciones para el ácido sulfúrico son las siguientes (European Chemicals Agency, 2017; Naciones Unidas, 2015; PubChem, 2017):
Clases de peligro del SGA
H303: Puede ser nocivo si se ingiere [Advertencia Toxicidad aguda, oral – Categoría 5] (PubChem, 2017).
H314: Provoca quemaduras graves en la piel y lesiones oculares [Peligro Corrosión / irritación cutáneas – Categoría 1A, B, C] (PubChem, 2017).
H318: Provoca lesiones oculares graves [Peligro Lesiones oculares graves / irritación ocular – Categoría 1] (PubChem, 2017).
H330: Fatal por inhalación [Peligro Toxicidad aguda, inhalación – Categoría 1, 2] (PubChem, 2017).
H370: Provoca daños a los órganos [Peligro Toxicidad específica en órganos diana, exposición única – Categoría 1] (PubChem, 2017).
H372: Provoca daños a los órganos tras exposiciones prolongadas o repetidas [Peligro Toxicidad específica en órganos diana, exposición repetida – Categoría 1] (PubChem, 2017).
H402: Nocivo para la vida acuática [Peligroso para el medio ambiente acuático, peligro agudo – Categoría 3] (PubChem, 2017).

Comentarios
Publicar un comentario